摘要
根據(jù)《國家食品藥品監(jiān)督管理總局立法程序規(guī)定》(總局令第1號),CFDA制定了2018年立法計(jì)劃�,經(jīng)局務(wù)會議審議通過,予以公布����。
內(nèi)容
為貫徹落實(shí)黨的十九大精神,食品藥品監(jiān)管總局堅(jiān)持圍繞中心���、服務(wù)大局���、突出重點(diǎn)��、協(xié)調(diào)推進(jìn)�����,以2020年基本建成科學(xué)完備的食品藥品安全法律制度體系為目標(biāo)���,根據(jù)《國家食品藥品監(jiān)督管理總局立法程序規(guī)定》(總局令第1號),制定了2018年立法計(jì)劃�,經(jīng)局務(wù)會議審議通過,予以公布�����。
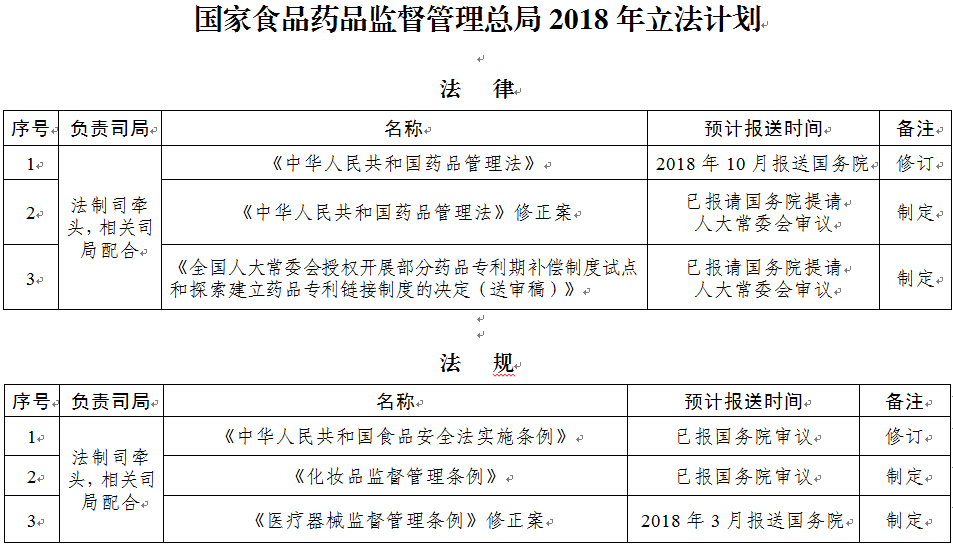
2018年立法項(xiàng)目共36部���,其中����,法律3部:一是繼續(xù)推動《中華人民共和國藥品管理法》修正案出臺����;二是繼續(xù)推動《全國人大常委會授權(quán)開展部分藥品專利期補(bǔ)償制度試點(diǎn)和探索建立藥品專利鏈接制度的決定》出臺;三是形成《中華人民共和國藥品管理法》修改草案送審稿����,按程序報(bào)請國務(wù)院審議。
法規(guī)3部:一是推動完成《中華人民共和國食品安全法實(shí)施條例》修訂��;二是加快《醫(yī)療器械監(jiān)督管理?xiàng)l例》修改進(jìn)程����,力爭第一季度向國務(wù)院報(bào)送修正案草案;三是繼續(xù)推動《化妝品監(jiān)督管理?xiàng)l例》盡快出臺。
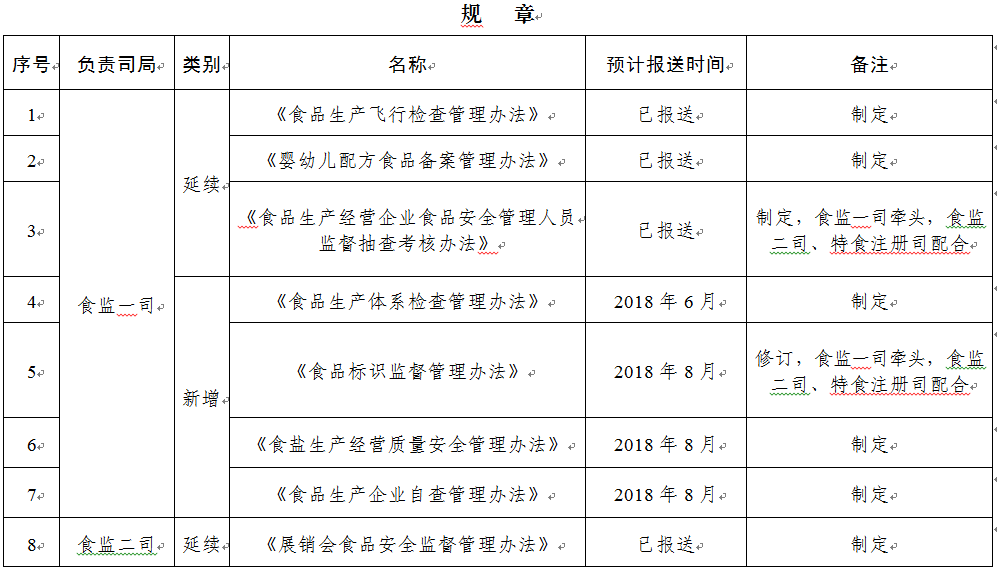
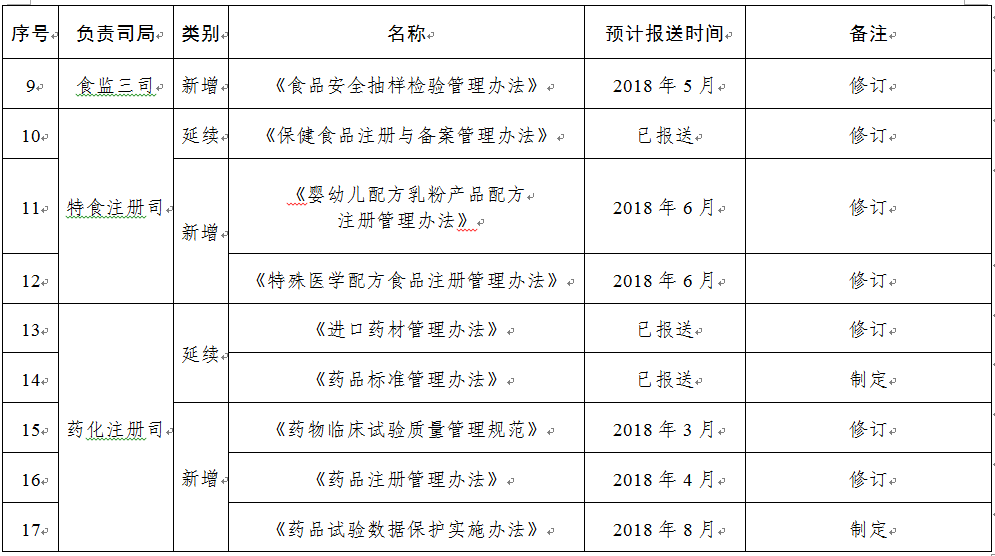
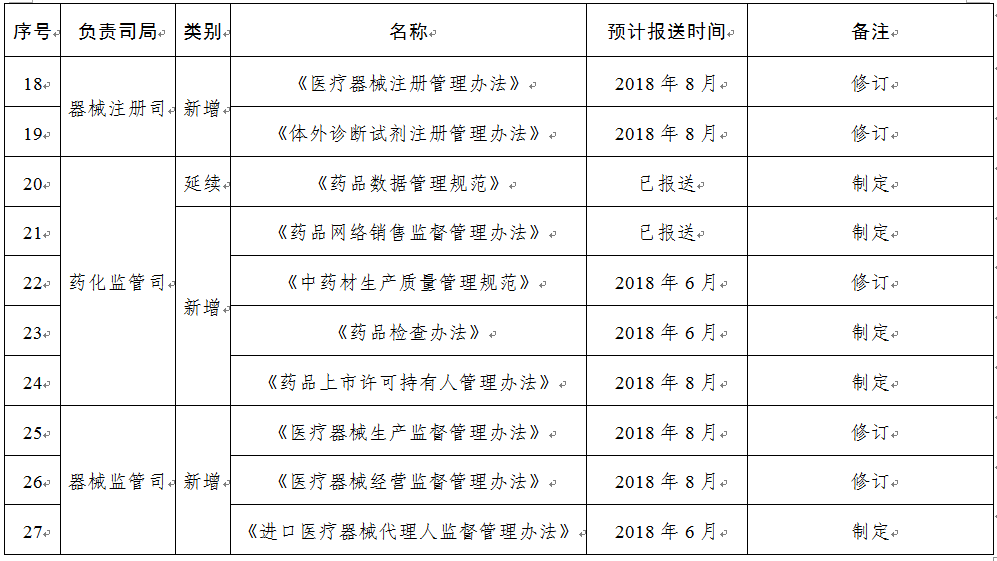
規(guī)章31部:一是圍繞食品安全法���,制修訂食品類配套規(guī)章12部����;二是按照深化藥品醫(yī)療器械審評審批制度改革要求���,制修訂藥品醫(yī)療器械類規(guī)章15部�����;三是為加快食品藥品法治建設(shè)����,制修訂綜合類規(guī)章4部。
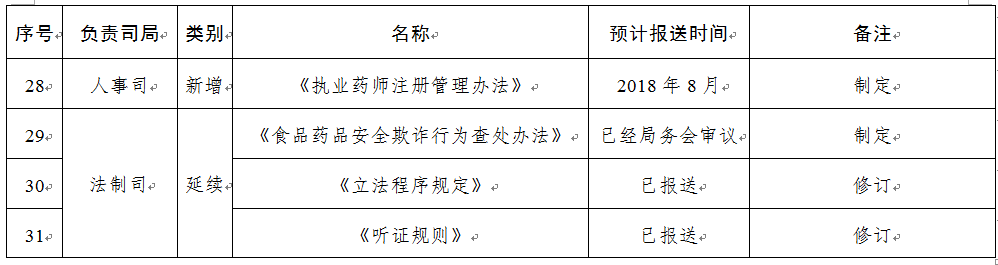
相關(guān)資料